Гальванические пары металлов
Вы здесь:
оглавление//
гальванические пары металлов
Обучение и техническая поддержка для проектировщика на Prof-il.ru
гальванические пары металлов
Атмосферная коррозионная стойкость алюминия обьясняется наличием оксидной пленки, образующейся сразу после взаимодействия металла с кислородом воздуха (Литер.: В.Ф. Хенли "Анодное оксидирование алюминия и его сплавов").
Табл. 1 Совместимость металлов и сплавов
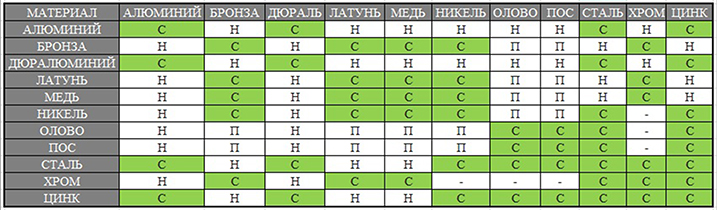
С - совместимые
Н - несовместимые
П - совместимые при пайке, но несовместимые при непосредственном соприкосновении, так как образуют гальваническую пару
ПОС - припой оловянно-свинцовый
Сталь - нелегированная
Пример нежелательных гальванических пар:
1 ПАРА: алюминий и все сплавы на его основе не рекомендуется и недопустимо сочетать:
- с медью и ее сплавами
- с серебром
- с золотом
- с платиной
- с палладием
- с родием
- с оловом
- с никелем
- с хромом
2 ПАРА: алюминий и все сплавы на его основе не рекомендуется и недопустимо сочетать:
- с титаном и с его сплавами
3 ПАРА: магниево-алюминиевые сплавы не рекомендуется и недопустимо сочетать:
- с хромом
- со свинцом
- со сталью легированной и нелегированной
- с медью
- с серебром
- с золотом
- с платиной
- с палладием
- с родием
- с оловом
- с никелем
4 ПАРА: цинк и его сплавы не рекомендуется и недопустимо сочетать:
- с медью и ее сплавами
- с серебром
- с золотом
- с платиной
- с палладием
- с родием
5 ПАРА: никель и хром не рекомендуется и недопустимо сочетать:
- с медью и ее сплавами
- с серебром
- с золотом
- с платиной
- с палладием
- с родием
6 ПАРА: сталь нелегированная, олово, свинец, кадмий не рекомендуется и недопустимо сочетать:
- с серебром
- с золотом
- с платиной
- с палладием
- с родием
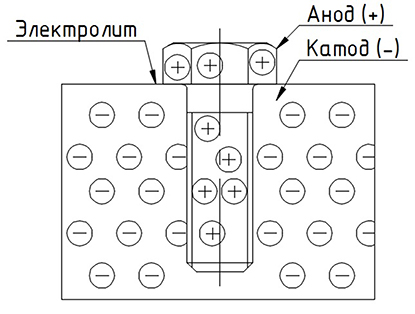
Рисунок 1 - Гальваническая коррозия двух деталей из разнородных металлов
Гальваническая коррозия более активного металла начинается в тот момент, когда две или более детали из разнородных металлов, имеющие взаимный контакт (благодаря обычному соприкосновению, или же посредством проводника) помещаются в электролит (любую жидкость, проводящую электричество). Электролитом может быть что угодно, за исключением химически чистой воды. Не только соленая морская, но и обычная вода из-под крана благодаря наличию минеральных веществ является превосходным электролитом, и с ростом температуры электропроводность ее только растет.
Катод — электрод, на котором происходит процесс восстановления, а анод — это электрод, где протекают окислительные процессы.
Ряд активности металлов (электрохимический ряд напряжений металлов)
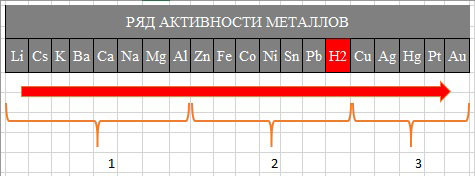
1 - Активные металлы
2 - Металлы средней активности
3 - Неактивные металлы
Химическая коррозия - металлы защищают себя оксидной пленкой на своей поверхности, является ли она самовосстанавливающейся, вот вопрос, как в случае алюминия, нержавеющей стали, цветных металлов или же как у стали отделяется.
оглавление
контакты
Свяжитесь с нами
Перейти
Получите помощь от экспертов по
интересующим вас вопросам
Задайте вопрос
© PROF-IL.RU 2016 - | При использовании материалов сайта, пожалуйста, указывайте ссылку https://prof-il.ru | Информация на сайте не является публичной офертой. | Обо всех замеченных ошибках при работе сайта просьба сообщать при помощи формы обратной связи. | Настоящий ресурс может содержать материалы 18+
Компьютерная версия сайта